Tests disponibles
Polymérase Chain Reaction (PCR)

- Détecte la présence de séquences d'acide nucléique (ARN) viral spécifiques.
- Types d'échantillons : sérum ou tissu.
- Pour :
- Méthode la plus sensible et privilégiée pour détecter l'agent.
- Les échantillons peuvent souvent être regroupés pour réduire le coût et minimiser la perte de sensibilité.
- Contre :
- Coût modéré.
- Nécessite des amorces appropriées.
Anticorps fluorescents (FAT)
- Détecte la présence de virus.
- Types d'échantillons : tissus, en particulier les amygdales.
- Pour :
- Bonne sensibilité.
- Contre :
- Ne fait pas de distinction entre la vaccination et l'infection virale sur le terrain.
- Les vaccins vivants modifiés peuvent entraîner un FAT positif pendant environ 2 semaines.
- Non réalisable pour un grand nombre d'échantillons.
- Les résultats dépendent de la souche virale utilisée dans le test.
- La fiabilité dépend fortement de la compétence des techniciens.
- Ne fait pas de distinction entre la vaccination et l'infection virale sur le terrain.
Immunoperoxydase différentielle utilisant des anticorps monoclonaux (AcMs)
- Détecte la présence de l'agent.
- Types d'échantillons : amygdale ou autre organe positif au FAT.
- Utilise une série de trois anticorps monoclonaux (AcMs) différents pour distinguer entre la vaccination, l'infection par le virus sur le terrain et les autres Pestivirus.
- Pour :
- Permet de faire la distinction entre la vaccination, l'infection par le virus terrain et les autres Pestivirus.
- Contre :
- Coût modéré à élevé.
- Il faut un échantillon de tissu FAT positif.
- Les résultats dépendent des trois différents AcMs et d'un anticorps polyclonal (AcP) utilisés dans le test.
- AcMs qui reconnaissent toutes les souches virales du PPC.
- AcMs qui reconnaissent toutes les souches de vaccin contre la PPC utilisées dans ce pays.
- AcMs reconnaissant le virus de la diarrhée bovine (BVD) et la maladie des frontières ou Border Disease (BD).
- AcPs qui reconnaissent le LCR.
- Non réalisable pour un grand nombre d'échantillons.
- La fiabilité dépend fortement de la compétence des techniciens.
Test ELISA (Enzyme-linked immunosorbent assay)
- Détecte la présence d'anticorps.
- Types d'échantillons : sérum.
- Pour :
- Les animaux restent positifs pendant plusieurs semaines.
- Peut être utilisé dans les cas chroniques.
- Peut être utilisé pour différencier l'exposition au virus de terrain du vaccin avec des gènes supprimés.
- Tout résultat positif pour le virus de terrain est considéré comme significatif.
- Contre :
- Si possible, il faut faire correspondre le test approprié à la délétion génique appropriée dans le vaccin (généralement E2).
- Il faut au moins 21 jours pour que les animaux deviennent séropositifs.
- Une réactivité croisée avec d'autres Pestivirus peut se produire.
Neutralisation virale (VN)
- Détecte la présence d'anticorps.
- Types d'échantillons : sérum.
- Pour :
- Les animaux restent positifs pendant plusieurs semaines.
- Peut être utilisé dans les cas chroniques.
- Sensibilité plus élevée que le test ELISA (peut détecter une concentration d'anticorps plus faible).
- Contre :
- Non réalisable pour un grand nombre d'échantillons.
- Il faut au moins 21 jours pour que les animaux deviennent séropositifs.
- Ne fait pas de distinction entre la vaccination et l'infection virale sur le terrain.
- La fiabilité dépend fortement des compétences du technicien.
- La réactivité dépend de la souche virale utilisée.
- Une réactivité croisée avec d'autres pesticivirus peut se produire.
Interprétation des résultats :
PCR
- Positif : le virus terrain ou la souche vaccinale est présent.
- Négatif : Négatif ou le virus n'est pas détecté si le test est effectué longtemps après l'infection.
FAT
- Positif : le virus terrain ou la souche vaccinale est présent.
- Négatif : Négatif ou le virus n'est pas détecté si le test est effectué longtemps après l'infection.
Immunoperoxydase avec AcMs
- Positif : voir le tableau 1.
- Négatif : Négatif ou le virus n'est pas détecté si le test est effectué longtemps après l'infection.
Tableau 1. Interprétation des résultats des tests immunoperoxydases différentiels utilisant des anticorps monoclonaux (AcMs). Source : OIE
.
| Anticorps polyclonal | Anticorps monoclonal spécifique pour | Interprétation | ||
|---|---|---|---|---|
| Souche PPC | Souche vaccinale PPC | Souche BVD/BD | ||
| + | + | — | — | Souche terrain de PPC |
| + | + | + | — | Souche vaccinale de PPC |
| + | — | — | + | Souche de BVD/BV |
| + | — | — | — | Autres virus non PPC Pestivirus* |
* L'existence de nouvelles souches de peste porcine classique doit toujours être prise en compte et tout isolat provenant de cas suspects de peste porcine classique doit être envoyé à un laboratoire de référence de l'OIE.
ELISA
- Positif : anticorps maternels ou exposition antérieure (>21 jours) au vaccin ou au virus terrain.
- Négatif : Négatif ou exposition au vaccin ou au virus terrain trop récente pour être détectée.
Le tableau 2 permet de démontrer les capacités DIVA (différenciation entre les animaux infectés et vaccinés) de certains tests ELISA lorsqu'on utilise un vaccin dont les gènes sont délétés.
| ELISA non différentielle | Résultat ELISA-E2 | Interpretación |
|---|---|---|
| Positif | Positif | Animal exposé au virus terrain |
| Positif | Négatif | Animal vacciné non exposé au virus terrain |
| Négatif | Positif | Erreur d'analyse. Ce résultat n'est pas possible |
| Positif | Négatif | Animal non vacciné et non exposé au virus terrain |
VN

- Positif : anticorps maternels ou exposition antérieure (>21 jours) au vaccin ou au virus terrain.
- Négatif : Négatif ou exposition au vaccin ou au virus terrain trop récente pour être détectée.
Scénarios
Il est important de noter que certains pays peuvent exiger l'approbation de l'autorité compétente avant de procéder à tout test de PPC
En France les pestes porcines classique (PPC) et africaine (PPA) sont des dangers sanitaires de première catégorie à déclaration obligatoire, soumis à plan d'intervention sanitaire.
Il est de la responsabilité de l’éleveur ou du vétérinaire de signaler immédiatement à la DDecPP tout cas répondant aux critères de suspicion clinique de peste porcine d'urgence. Les analyses seront réalisées ensuite dans des laboratoires agrées avec des analyses autorisées pour cette situation.
Les scénarios ci-dessous sont généraux et ne correspondant pas forcément à la règlementation en vigueur en France
Suspicion de foyer aigu de PPC chez des porcs de tout âge et dans des exploitations non vaccinées contre la PPC.
- Prélever du sang sur plusieurs animaux atteints et le tester par PCR ; le regroupement des échantillons peut être envisagé.
- Prélever des rates et des amygdales sur les porcs morts et les analyser par PCR ; la mise en commun des échantillons peut être envisagée.
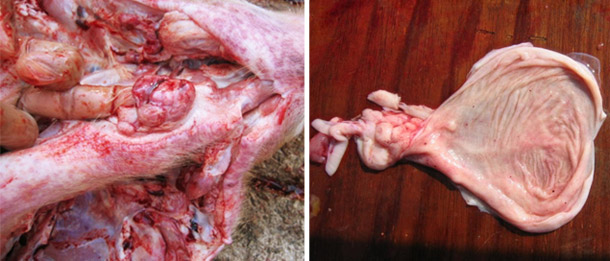
Suspicion de foyer aigu de PPC chez des porcs de tout âge et dans des exploitations vaccinées contre la PPC.
- Prélever du sang sur plusieurs animaux atteints qui n'ont pas été vaccinés contre la PPC au cours des 2 dernières semaines et effectuer un test par PCR ; la mise en commun des échantillons peut être envisagée.
- Prélever des rates ou des tissus et des amygdales sur des porcs morts et les tester par PCR ; le regroupement des échantillons peut être envisagé.
- Si la PCR est positive, tester l'échantillon de tissu par FAT et immunoperoxydase avec des AcMs.
Suspicion de circulation chronique de PPC chez des porcs de tout âge sans mortalité et dans des exploitations non vaccinées contre la PPC
- Prélever du sang sur 30 porcs présentant des signes cliniques (échantillonnage ciblé) ou choisis au hasard (sans signes cliniques) et effectuer des tests par PCR (le regroupement des échantillons peut être envisagé) et individuellement par ELISA non différentielle.
Suspicion de circulation chronique de PPC chez les porcs de tout âge sans mortalité et dans les exploitations vaccinées contre la PPC.
- Prélever du sang sur 30 porcs (non vaccinés au cours des 2 dernières semaines) présentant des signes cliniques (échantillonnage ciblé) ou choisis au hasard (sans signes cliniques) et l'analyser par PCR (le regroupement des échantillons peut être envisagé) et individuellement par ELISA non différentielle et ELISA différentielle E2.