 |
|
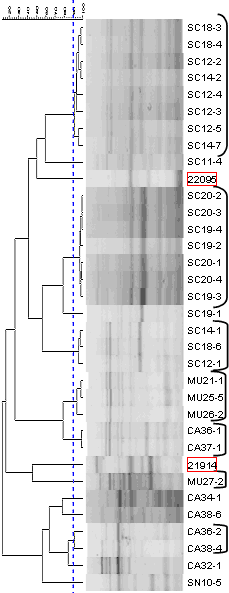
Les bandes d'ERIC-PCR peuvent être analysées avec des programmes spéciaux qui permettent de comparer les différents isolats. Différentes souches nasales ont été comparées entre elles et avec des souches isolées à partir de lésions dans les cadres rouges). Les bandes sont considérées comem équivalentes jusuq'à une limite de 90 % d'identité (ligne pointillée bleue).
|
 |
|
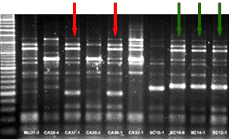
ERIC-PCR de souches nasales d'Haemophilus parasuis obtenues sur 3 élevages différents. Les isolats bactériens avec le même schéma de bandes sont une seule et même souche (signalés avec des flèches de la même couleur).
|
 |
|
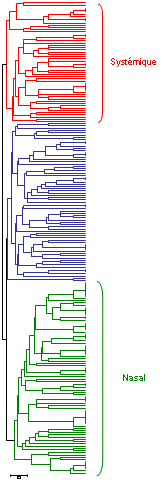
Classification de 211 souches d'Haemophilus parasuis par MLST. On observe un groupe associé à des souches isolées de lésions systémiques (en rouge), un autre groupe associé à des souches isolées de narines d'animaux sains (en vert) et un dernier groupe intermédiaire (en bleu).
|
Le porc est le seul milieu naturel d'Haemophilus parasuis, qui, en plus, manque de capacité pour survivre dans le milieu extérieur. C'est pourquoi la transmission de cette bactérie se fait toujours par contact avec des animaux colonisés ou infectés par celle-ci. Ainsi, les porcelets reçoivent la bactérie de leur mère et H. parasuis peut être isolé comme colonisateur du tractus respiratoire supérieur d'animaux sains ayant peu de jours de vie. En conséquence, la prévalence d'H. parasuis dans des élevages conventionnels est pratiquement de 100 %, bien que l'incidence de la maladie soit moindre. Dans un élevage conventionnel sain, il est normal d'isoler différentes souches d'H. parasuis qui restent en équilibre avec l'immunité des animaux. Cependant, des déséquilibres, comme l'introduction de nouvelles souches par le mélange d'animaux, peuvent entraîner l'apparition de la maladie.
Des données des USA indiquent une incidence de 7 % de la maladie de Glässer en 2000, qui a été en augmentation jusqu'à 17 % en 2006.
Par conséquent, il est important de pouvoir identifier les différentes souches circulant et de distinguer les souches colonisatrices normales de celles capables de produire la maladie. Pour cela, différentes méthodes de classification ou “typage” des souches d'H. parasuis ont été développées.
Les méthodes de typage peuvent être utiles dans des études épidémiologiques locales ou globales. Les études locales visent à l'analyse des souches présentes dans un élevage ou dans des élevages ayant un lien entre eux pour déterminer l'introduction de nouvelles souches ou pour vérifier si un traitement a éliminé la souche ayant provoqué une flambée. De leur côté, les études générales analysent les relations entre des souches particulières avec d’autres isolées à des périodes ou dans des lieux différents.
Classiquement, les souches d'H. parasuis ont été classées selon leur sérotype.
En 1992, Kielstein et Rapp-Gabrielson ont établi 15 sérotypes d'H. parasuis et ont déterminé la virulence des souches de référence des différents sérotypes par infection expérimentale. Selon cette classification, les sérotypes les plus virulents sont les 1, 5, 10, 12, 13 et 14. Dans des études réalisées dans des différents pays, on a observé que les sérotypes les plus prévalents sont le 5 et le 4, le 4 étant de virulence modérée. Bien que le sérotypage ait l'avantage de fournir l'information sur la réaction antigénique des souches, son plus grand problème est qu'il existe une grande quantité de souches non typables (entre 15 et 41 %).
Pour éviter ce problème, on a commencé à développer les méthodes de génotypage, qui analyse le matériel génétique présent dans toutes les souches. Le plus grand inconvénient du génotypage est le manque d'information directe, car les classifications obtenues doivent être complétées avec d'autres données, comme l'origine clinique de la souche. Il existe plusieurs méthodes de génotypage, qui sont basées autant sur la comparaison de profils de bandes que sur la comparaison de séquences.
Un exemple de méthode de comparaison de bandes utilisée dans la classification des souches d'H. parasuis est l'ERIC-PCR (“enterobacterial repetitive intergenic consensus” PCR). Cette technique est utile dans des études locales de souches d'H. parasuis, mais sa reproductibilité n'est pas bonne et les résultats de différents laboratoires ne peuvent pas être comparés.
Pour améliorer le génotypage des techniques de séquençage, comme “multilocus sequence typing” ou MLST ont été développé. Grâce au MLST, les souches d'H. parasuis ont été classées dans différents groupes ayant un rapport avec la virulence potentielle des souches. Un groupe comprenait des souches associées à une maladie systémique et des souches virulentes de référence, tandis qu'un autre groupe comprenait des souches nasales d'animaux sains et des souches de référence non virulentes.
Les méthodes de génotypage ont un grand potentiel pour la réalisation d'études épidémiologiques d'H. parasuis mais demandent plus d'efforts pour mettre en relation la classification génomique et la virulence réelle des souches.

Virginia Aragón. CRESA. Espagne



