Escherichia coli entérotoxinogène (ETEC) est le pathogène responsable de la diarrhée néonatale (DN), de la diarrhée post-sevrage (DPS) et de la maladie de l’œdème (MO) chez les porcs. Bien que la colibacillose touche les jeunes animaux allaitants et en post-sevrage, on peut aussi l’isoler sur des animaux en phase de croissance et d’engraissement. ETEC adhère aux microvillosités de l’intestin grêle par les fimbriæ F4, F5, F6, F18 et F41 et produit des entérotoxines qui agissent localement dans les entérocytes. Les entérotoxines d’ETEC sont classées en toxines thermolabiles LTa (eltA), LTb (eltB) et en toxines thermostables STa (estI), STb (estII) et EAST1 (astA). On a démontré que la seule présence d’ETEC dans l’intestin n’est pas suffisante pour entraîner la maladie clinique (Dewey SE et al, 1995). La pathogénie d’ETEC est complexe, beaucoup de gènes doivent être régulés pour produire, activer et secréter les facteurs de virulence. Des facteurs environnementaux comme la température, la concentration ionique, Fe++, le pH, l’oxygène peuvent aussi induire la modulation dans l’expression de ces gènes. Parallèlement, de nombreux facteurs de management comme les changements d’aliments, le sevrage précoce ou le flux continu pourraient aussi affecter les formes cliniques de l’ETEC.
Dans cette étude, on a recherché la prévalence des porcs ETEC positifs (ETEC+) dans les élevages sans signe clinique de diarrhée ainsi que le schéma de résistance aux antibiotiques observé contre les souches isolées d’ETEC. On a réalisé une étude transversale qui comprenait 11 élevages sans signe clinique ou sans historique de colibacillose. Les élevages inclus dans cette étude ont présenté les caractéristiques suivantes : nombre de truies (225 ± 30) et porcs envoyés à l’abattoir /an (au moins 250 porcs envoyés à l’abattoir/an).Tous les élevages inclus dans cette étude étaient des naisseurs-engraisseurs et présentaient le même type de conduite. On a prélevé 90 écouvillons rectaux dans chaque élevage pour déterminer la présence d’E. coli porteur de gènes eltA, estI ou les deux et pour déterminer la prévalence des différents génotypes dans chaque stade de production. Trente porcs ont été choisis au hasard dans l’un des stades suivants de production : maternité (porcs sevrés, 21±3 jours) : post-sevrage (porcelets sevrés, 86±3 jours) ; engraissement (porcs d’engraissement, 165±3 jours). Les porcs considérés ETEC+ ont été ceux pour lesquels on a détecté les gènes eltA, eltI ou les deux.


Prévalence des gènes eltA et eltI sur des porcs non diarrhéiques
Sur un total de 900 échantillons évalués, 150 (15,2% - 92% CI±2,24) ont été positifs en eltA, estI ou les deux. Sur les 150 échantillons ETEC+, 82,7% (95% CI±6,05), 11,3% (95%CI±5,7) et 6% (95%CI+-3,8) ont été respectivement positifs en estI, estA et estI/estA. La proportion totale d’animaux ETEC+ a augmenté de 16,6% (95% CI±5,95) en maternité, de 66% (95%CI ± 7,58) en post-sevrage. Le pourcentage de porcs porteurs d’ETEC+ a chuté brusquement à 17,3% (95% CI ±6,05) dans l’engraissement. On a observé des animaux porteurs d’ETEC+ sous forme subclinique dans 10 des 11 élevages sondés. Chez 150 porcs porteurs de souches ETEC+, 40 souches ETEC+ (26,7%) (95% CI±13,71) ont été isolées de 30 échantillons en post-sevrage (75%) 95 CI ±13,42) 8 d’engraissement (20%) (95% CI ± 12,4) et deux de maternité (5%) (95% CI ± 6,75).
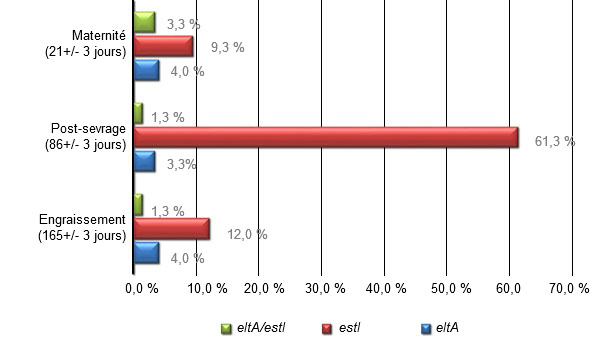
Figure 1 : prévalence de souches positives en gènes eltA (toxine LT) et/ou estI (toxine STa) obtenue de souches d’E. coli isolées de la zone de confluence dans le bouillon trypticase soja (TSA)
Un total de 90 écouvillons rectaux ont été prélevés dans chaque élevage afin de déterminer la prévalence des gènes eltA (toxine LT) et /ou estI (toxine STa) et la prévalence subséquente des différents génotypes dans les différents niveaux de production. 30 animaux ont été choisis au hasard dans chaque phase de production (maternité, post-sevrage et engraissement).
Sensibilité antimicrobienne des souches ETEC isolées de porcs non diarrhéiques.
Deux des quarante souches isolées ont été sensibles à tous les agents antimicrobiens mesurés. Toutes les souches ont été sensibles à l’amikacine (AMK), la colistine (CST), le cefotaxime (CTX) et la cefoxitine (CXT). Trente-huit souches (95%) ont été résistantes au moins à un antimicrobien et toutes les souches ont présenté de la résistance à TET. On a observé dix-huit profils de résistance antimicrobienne différents et on a observé de la résistance antimicrobienne multiple (MRA) à plus de 3 antibiotiques sur 52,5% des souches (figure 2).
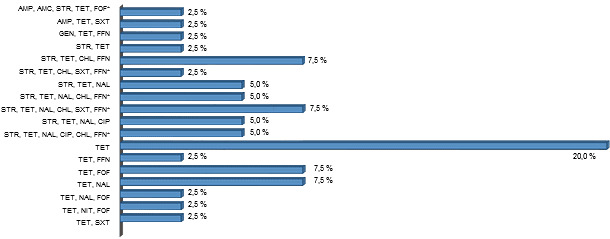
Figure 2 : profil de résistance antimicrobienne sur des souches ETEC isolées de porcs non diarrhéiques.
Sur les quarante souches ETEC+ isolées, on a observé 18 profils différents de résistance antimicrobienne multiple (MRA). Le pourcentage observé sur le total des isolats pour chaque profil antibiotique est exprimé en barres horizontales.
Ampicilline (AMP), Céfalotine (CEP), Amoxicilline/Acide clavulanique (AMC), Gentamycine (GEN), Streptomycine (STR), Tétracycline (TCY), Acide nalidixique (NAL), Ciprofloxacine (CIP), Chloramphénicol (CHL), Florfénicol (FLO), Triméthoprime-Sulfa (SXT), Nitrofurantoïne (NIT), Fosfomycine (FOF). * = résistance antibiotique multiple.

Au cours de cette étude, on a observé que de nombreux génotypes d’ETEC cohabitaient et circulaient dans des populations de porcs sans manifestation clinique de diarrhée néonatale, de diarrhée post-sevrage ou de maladie de l’œdème aux différents stades de production. De nombreux profils de résistance antibiotique ont été observés sur des souches isolées d’ETEC, obtenues d’animaux sans manifestation clinique. L’information générée est importante d’un point de vue diagnostic et épidémiologique et pour comprendre la dynamique et l’écologie d’ETEC chez les porcs aux différents stades de production qui pourraient être la cause de la colibacillose clinique.



