Les problèmes de reproduction induits par le virus SDRP se caractérisent par la mort embryonnaire, des avortements tardifs, des mises-bas prématurées et une augmentation du nombre de fœtus morts et faibles. Les récentes découvertes montrent que l’endomètre et le placenta sont impliqués dans le passage du SDRP de la mère au fœtus et que la réplication du virus dans les tissus de l’endomètre/placenta peut être la vraie raison de la mort fœtale. Mieux comprendre ce phénomène pourrait faciliter les stratégies préventives.
La présence de cellules diana du SDRP dans l’endomètre et le placenta pourrait être essentielle pour le passage du virus de la mère aux fœtus. En rapport avec cela, il y a plus de cellules CD163+ et Sn+ (les cellules diana de l’infection par le SDRPv) dans l’endomètre et le placenta, récoltées à 90-110 jours de gestation, que dans les états antérieurs. L’abondance de cellules très sensibles au virus dans le placenta en fin de gestation peut expliquer, en partie, pourquoi l’infection congénitale est essentiellement restreinte à la fin de gestation. Une expérience précédente avec challenge a révélé que l’environnement de l’endomètre pourrait aussi jouer un rôle important dans l’établissement d’infections placentaires et transplacentaires. On n’a pas observé de cellules positives au SDRPv dans le tissu endométrial adjacent sur les onze fœtus d’une truie qui avait été inoculée par voie intranasale avec le SDRP à 70 jours de gestation et prélevée à 80 jours de gestation, malgré la virémie maternelle et la présence de cellules endométriales CD163+ et Sn+. A l’inverse, le SDRPv s’est répliqué efficacement dans l’endomètre/placenta prélevé sur des truies inoculées par voie intranasale avec le SDRP à 90 jours de gestation et prélevées à 100 jours. Par conséquent, il y a des facteurs encore méconnus qui préviennent ou bloquent la réplication du SDRPv dans l’endomètre qui, avec un nombre insuffisant de cellules sensibles dans le placenta, pourraient entraîner de la résistance à l’infection placentaire/transplacentaire avant les 90 jours de gestation.

Dans une étude récente, on a identifié, localisé et quantifié des cellules positives au SDRPv et des cellules apoptotiques dans l’endomètre/placenta de trois truies inoculées à 90 jours de gestation et abattues 10 jours après. A 10 jours post-inoculation, les truies ainsi challengées étaient virémiques et le SDRP était passé de la mère au fœtus dans tous les cas. Au moyen d’une coloration spécifique par immunofluorescence, on a détecté une réplication du SDRP dans l’endomètre et le placenta des truies inoculées. Le nombre de cellules positives au SDRPv dans le placenta (1-289/10 mm² de tissu) était significativement plus important que dans l’endomètre (1-16/10 mm² de tissu ; p = 0,004). La quantité de cellules apoptotiques était significativement plus importante dans l’endomètre positif au SDRPv des truies inoculées que dans les tissus négatifs au virus du SDRP des truies témoin (figure 1). La quantité de cellules apoptotiques a significativement augmenté dans les placentas positifs au SDRP par rapport aux placentas négatifs au SDRP. La principale conclusion de cette étude est que le SDRPv se réplique dans l’endomètre/placenta et cause de l’apoptose de cellules locales en fin de gestation. On observe plusieurs lésions histo-pathologiques dans les tissus positifs au virus qui varient depuis la séparation locale entre l’épithélium utérin et le trophoblaste à la dégradation complète du mésenchyme fœtal placentaire, autour des 20 jours après l’inoculation (figure 2). Ces lésions histopathologiques sont incompatibles avec la vie fœtale puisque l’intégrité entre la partie maternelle et la partie fœtale à l’intérieur de l’interface materno-fœtale est essentielle pour l’échange gazeux utérin (O2/CO2), l’alimentation et l’élimination des métabolites toxiques fœtaux.
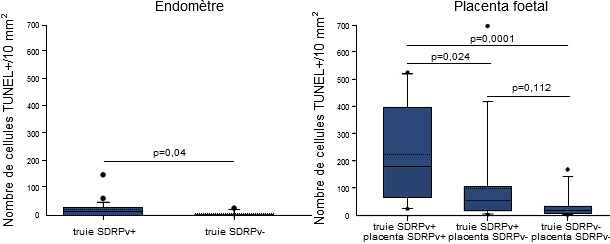
Figure 1 : Quantification de cellules apoptotiques dans l’endomètre et le placenta prélevées de truies inoculées avec le SDRPv à 90 jours de gestation et de truies non inoculées.
Les animaux ont été prélevés à 100 jours de gestation. Les lignes pleines et en pointillées sont respectivement les médianes et les moyennes. Chaque case représente 25-75% des observations. Les marques en dessous et au-dessus représentent les 10 et 90 %. Les points en-dessous ou au-dessus des marquesde chaque case représentent des valeurs atypiques non comprises entre 10 et 90% des observations. On considère statistiquement les différences significatives quand p ≤ 0,05.

Figure 2 : Histopathologie de l’endomètre et du placenta
Zones d’implantation fœtale d’un fœtus négatif SDRPv sans microlésions (PSM : pli secondaire maternel ; epm : épithélium utérin (maternel) ; tr : trophoblaste).Zones d’implantation fœtale de fœtus positifs SDRPv avec des microlésions : (B) trophoblaste détaché localement de l’épithélium utérin ; (C) dégénérescence focale du placenta : (D) dégénéraescence multifocale du placenta fœtal et (E) dégénérescence complète du placenta fœtal. (Karniychuk et al., 2012).
Actuellement, la vaccination est considérée comme la principale méthode pour le contrôle et le traitement des infections par le SDRPv. Dans une récente étude, on a analysé un vaccin expérimental inactivé de SDRPv, produit par un nouveau procédé d’inactivation virale de qualité contrôlée et administré avec un adjuvent adapté. Les résultats ont montré que le nouveau vaccin inactivé est capable de renforcer la réponse des anticorps neutralisants du virus (VN) et de diminuer légèrement la durée de la virémie chez les nullipares. Il diminue aussi le nombre de fœtus positifs au SDRPv et améliore la survie fœtale. Les effets positifs ont été obtenus sans doute par la diminution du passage du virus de l’endomètre (le site primaire de réplication du SDRP avant l’infection de la progéniture) au placenta puisque le nombre de cellules positives au SDRPv dans les placentas est significativement plus élevé chez les nullipares non vaccinées que chez les vaccinées. On pourrait recommander l’utilisation de ce vaccin dans les élevages endémiquement atteints, seul ou en combinaison avec d’autres vaccins, pour diminuer les pertes dues à l’infection par le SDRPv chez les truies gestantes. L’objectif est d’activer la réponse VN avant les 80 jours de gestation quand les truies deviennent sensibles à l’infection placentaire/transplacentaire. La vaccination des nullipares avec un vaccin vivant avant l’insémination ou pendant la phase initiale de la gestation, avec une potentialisation postérieure avec le nouveau vaccin inactivé, peut offrir de nouvelles perspectives à la prévention des problèmes de reproduction dus au SDRPv.