Introduction
C'est un élevage commercial naisseur-engraisseur avec 400 truies en Irlande du Nord.

L'unité est négative pour la grippe porcine et le SDRP.
Le protocole de vaccination utilisé est illustré dans le tableau 1.
Tableau 1 . Programme de vaccination
| VACCIN | NULLIPARES | TRUIES | VERRATS | PORCELETS |
| Parvovirus | Injection de 2 ml à la sélection | Injection de 2 ml 2 semaines après mise-bas | ||
| Rouget | Injection de 2 ml à la sélection et 2 semaines avant insémination | Injection de 2 ml 2 semaines après mise-bas | Injection de 2 ml deux fois par an | |
| Colibalose | Injection de 2 ml 6 et 2 semaines avant mise-bas | Injection de 2 ml 2 semaines avant mise-bas | ||
| PCV-2 | Injection de 2 ml 3 semaines avant l'insémination et 3 semaines avant mise-bas | Injection de 2 ml 3 semaines avant mise-bas | Injection de 2 ml deux fois par an | |
| Pneu | 1 ml à 7 jours et au sevrage |
Les nullipares sont élevées sur l'élevage. Les nullipares et les truies sont inséminées par IA d'une seule origine.
Histoire
L'éleveur a contacté le vétérinaire en raison d'une augmentation des hémorragies et des hématomes sous-cutanés sur la peau de plusieurs porcelets dans huit portées différentes. Aucune mortalité n'a été attribuée au problème.
L'unité a connu ce problème au cours des trois dernières années, mais pas dans la même proportion que maintenant. Les signes cliniques apparaissent soudainement dans quelques portées et disparaissent ensuite pendant des périodes de temps.
Recherche
Recherche clinique
Lors de la visite de l'élevage, 28 porcelets provenant de 8 portées différentes ont présenté des hémorragies sous-épithéliales (Figures 1, 2, 3, 4 et 5). Les porcelets ont développé les signes cliniques après l'âge de 7 jours, après être nés normaux. Les porcelets affectés ont continué à téter et n'ont souffert d'aucun retard de croissance. Tous les porcelets des portées touchées ne présentent pas de signes cliniques externes.

Figure 1. Marques de bagaress et hémorragies sous-épithéliales disséminées chez les porcelets de 7 jours. Observer le sang séché sur les tapis thermiques 12 heures après la coupe des queues. Figure 2. Marques de bagarres et hémorragies sous-épithéliales disséminées chez les porcelets de 7 jours. Observer le sang séché sur les tapis thermiques et sur le train arrière 12 heures après la coupe des queues.
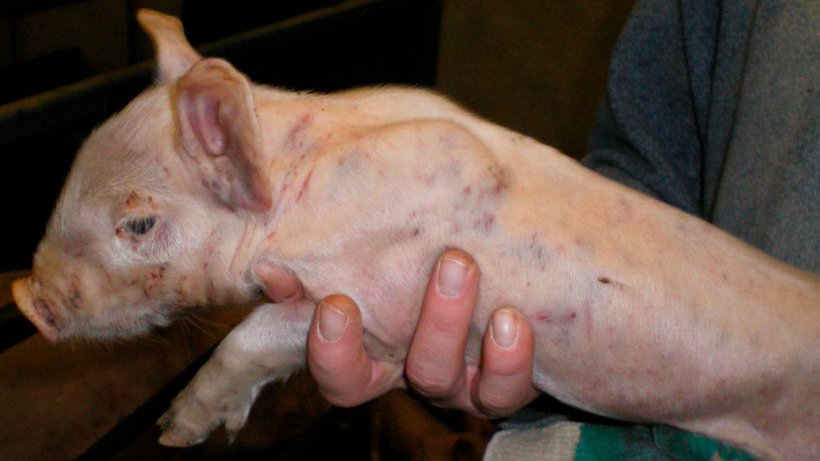
Figure 3. Marques de bagarres et hémorragies sous-épithéliales disséminées chez un porcelet de 7 jours.
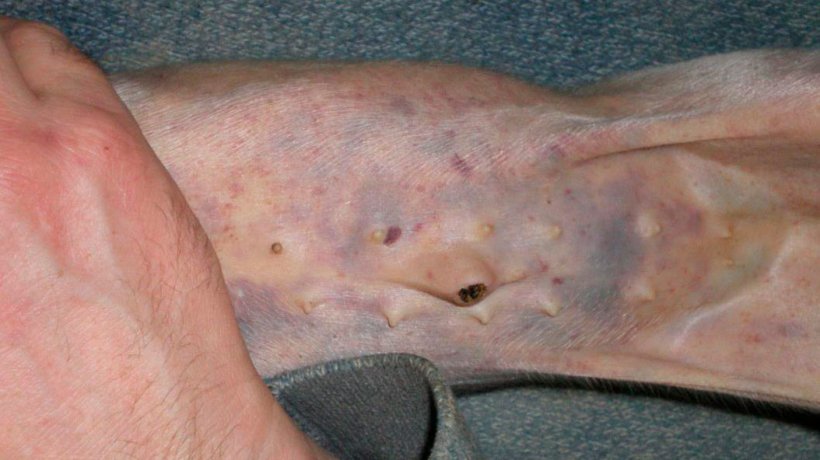
Figure 4. Hémorragies sous-épithéliales généralisées et pétéchies sur un porcelet de 7 jours.
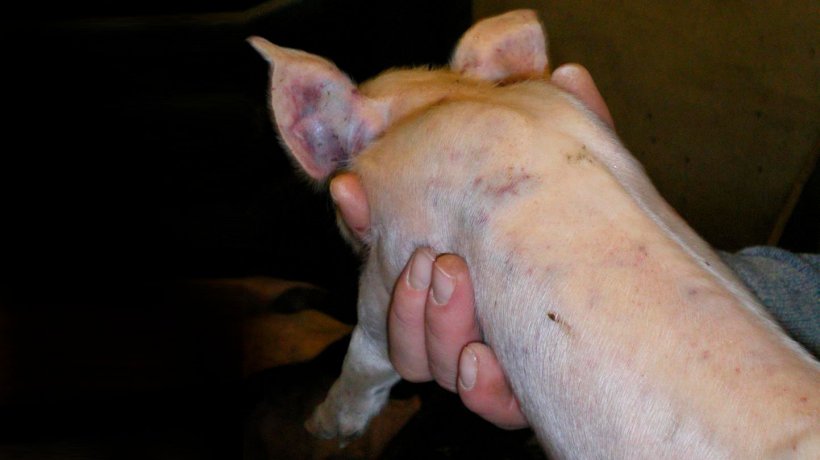
Figure 5. Marques de bagarres et hémorragies sous-épithéliales disséminées chez un porcelet de 7 jours.
Au moment de la visite, les porcelets c'était la coupe de queue. Les saignements de la queue étaient abondants et il y avait un retard dans la coagulation (figures 1 et 2).
Aucune fièvre n'a été détectée après avoir pris la température rectale de 10 porcelets affectés.
Recherches de laboratoire
Un porcelet récemment mort et un autre porcelet vivant et affecté de 7 jours ont été envoyés au laboratoire. Il a été demandé de prélever un échantillon de sang héparinisé pour hématologie. Les résultats de laboratoire sont résumés dans le tableau 2.
Les tests d'hématologie et de biochimie n'ont pas pu être réalisés à la suite de la coagulation du sang recueilli au laboratoire.
Les photographies post mortem sont présentées dans les figures 6, 7, 8 et 9.
Tableau 2. Résultats de laboratoire des 2 porcelets de 7 jours
| POST MORTEM | HISTOLOGIE | IMMUNOFLUORESCENCE | BACTERIOLOGIE | |
| PORCELET 1 (Mort) | • Hémorragies sous-éptthéliales superficielles généralisées avec des pétéchies sur la carcasse • Sang dilué et aqueux • Quelques hémorragies pétéchiales sur le coeur • Rein pâle avec des hémorragies pértéchiales • Foie pâle et ictérique |
•Pas d'anomalies significatives. | • Négatif en PPC et PCV-2. | • Pas d'isolement de bactéries significatives. |
| PORCELET 2 (Vivant) | • Hémorragies sous-épithéliales généralisées sur la carcasse • Sang dilué et aqueux • Hémorragies pétéchiales sur le rein et le poumon |
• Pas d'anomalies significatives. | • Négatif en PPC et PCV-2. | • Pas d'isolement de bactéries significatives |
PPC = Peste Porcine Classique
PCV-2 = Circovirus Porcine 2
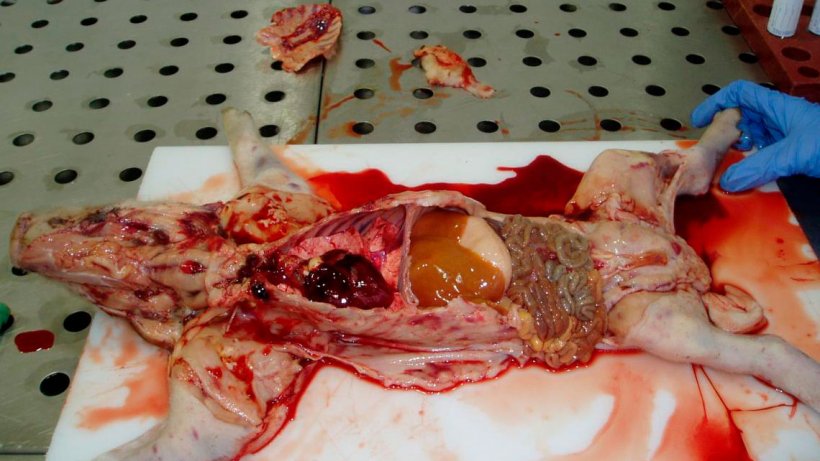
Figure 6. Porcelet de sept jours. Observer la carcasse pâle, les hémorragies et les pétéchies généralisées sur la peau. Le foie est ictérique. Tous les ganglions lymphatiques ont une apparence hémorragique.
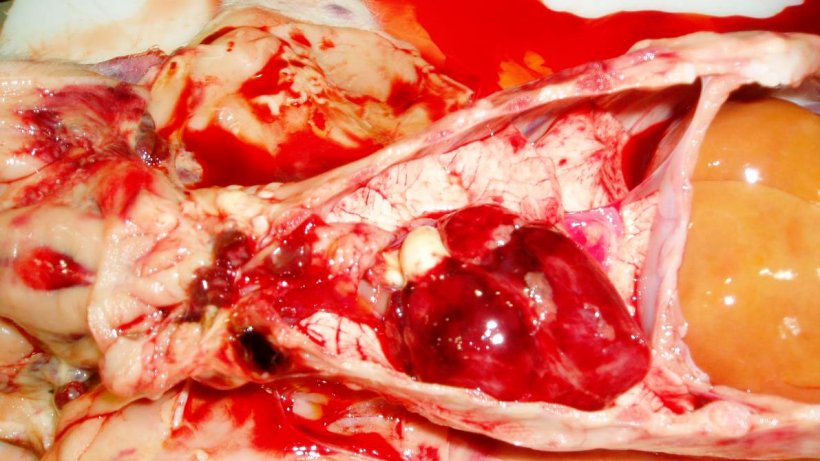
Figure 7. Cœur du porcelet de la figure 3. Observer les hémorragies pétéchiales sur le cœur et les ganglions lymphatiques hémorragiques.
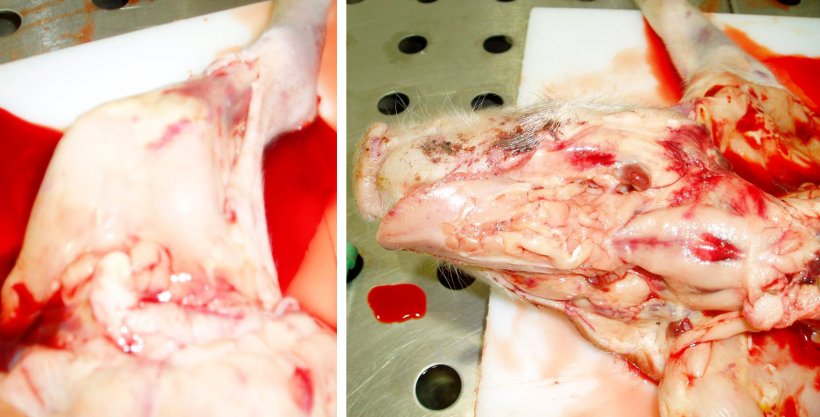
Figure 8. Carcasse pâle et hémorragies sous-épithéliales du membre postérieur gauche. Observer le sang dilué et aqueux sur la table. Figure 9. Carcasse pâle avec ganglions lymphatiques hémorragiques et hémorragies sous-épithéliales. Observer le sang dilué et aqueux sur la carcasse.
Diagnostic différentiel
Selon les études cliniques et de laboratoire, le diagnostic différentiel suivant a été fait:
- Purpura thrombocytopénique
- Carence en fer
- Carence en vitamine K (empoisonnement par les rodenticides)
- Peste porcine classique (PPC)
- Circovirose porcine (PCV-2)
Les agents viraux, tels que le virus de la PPC et du PCV-2, ont été exclus en raison de l'absence de signes cliniques compatibles avec ces maladies et des résultats négatifs du test d'immunofluorescence.
La carence en fer a été exclue en raison des injections de fer dextran qui sont administrées systématiquement à tous les porcelets par voie intramusculaire à l'âge de 2 jours et à des hémorragies sous-épithéliales disséminées.
La carence en vitamine K (intoxication par les rodenticides) ne peut être exclue du diagnostic différentiel sans hématologie. Comme mentionné en 4.2., L'échantillon de sang prélevé a été coagulé et aucune analyse hématologique / biochimique n'a pu être effectuée. Aucun rodenticide n'a été mis dans les salles de mises-bas.
Un diagnostic de purpura thrombocytopénique a été suggéré sur la base de l'histoire et des recherches cliniques et de laboratoire.
Programme de contrôle
Les adoptions croisées des portées affectées ont été faites avec d'autres truies.
Il a été recommandé que les truies qui produisent les portées touchées soient éliminées ou inséminées avec un autre verrat.
Réponse au programme de contrôle
Certains des porcelets affectés transférés à d'autres truies sont morts en quelques jours.
Aucun autre cas n'a été décrit par l'éleveur depuis lors.
Discussion
Le purpura thrombocytopénique est une hypersensibilité de type II (ou hypersensibilité de type cytotoxique) dans laquelle des auto-anticorps se forment contre les thrombocytes. Cela entraîne leur diminution et la diathèse hémorragique en tant que signe clinique associé. Ces auto-anticorps peuvent survenir à la suite de transfusions sanguines, d'utilisation de vaccins contenant des produits sanguins, ou chez des truies multipares qui développent des anticorps contre les allo-antigènes partagés par le père et le fœtus. Dans ce dernier cas, aucun signe clinique n'est attendu chez la truie, car elle ne produirait que des anticorps dirigés contre les antigènes de l'allotype de surface cellulaire non retrouvés dans ses cellules (Straw et al., 1999). Contrairement aux bébés et aux chiots, les anticorps ne sont pas transférés par le placenta de la truie à ses porcelets avant la naissance. Les porcelets naissent dans un état vulnérable sans anticorps humoraux ou associés à la muqueuse ni immunité acquise à médiation cellulaire (Muirhead et al., 1997a). Cela expliquerait pourquoi la gestation ne s'arrête pas. L'ingestion de ces auto-anticorps dans le colostrum et leur absorption par le porcelet entraîne une diminution des taux de thrombocytes circulants d'environ 200 x 109 / l à l'âge de 2 jours (normalement plus élevé, 250-300 x 109 / l). La récupération a lieu à 400x109 / l à 5 jours et à partir du 9ème jour, il diminue à 50x109 / l lorsque le purpura apparaît. Les mégacaryocytes et d'autres cellules de la moelle osseuse sont atteints et les thrombocytes circulants ne sont pas remplacés (Taylor, 1995).
Les transfusions sanguines et les vaccins contenant des produits sanguins, tels que le vaccin au cristal violet contre la peste porcine (Smith et al., 1990), n'ont pas été utilisés dans cet élevage. Par conséquent, la seule option était que les truies multipares aient développé des anticorps contre les alloantigènes partagés par le père et le fœtus. Les portées touchées provenaient d'un verrat Large White. Toutes les truies ayant produit une portée affectée avaient plus d'une parité. Selon Taylor (1995), pour que la maladie ait lieu, le type de thrombocyte du verrat doit différer de celui de la truie et cela doit avoir eu lieu au moins une portée avant avec un verrat de ce type de thrombocyte. Dans ce cas, les truies touchées avaient été inséminées en IA avec ce verrat dans une portée précédente. Taylor (1995) affirme que ce problème est plus fréquent chez les porcs de race Large White et Landrace et il est particulièrement fréquent lors de l'utilisation d'un verrat Large White avec une truie Landrace. Dans ce cas, un verrat Large White a été utilisé pour couvrir les truies Landrace ou Landrace x Large White. Pour cette raison, il a été recommandé de changer l'.A., ce qui a amélioré la situation sans avoir besoin de réformer les truies ou le verrat. Malheureusement, la numération des thrombocytes n'a pas pu être réalisée en raison de la coagulation de l'échantillon de sang prélevé au laboratoire. Une autre alternative aurait été de collecter du sang à la ferme. Cependant, depuis lors, il n'y a plus eu de cas.
Tous les porcelets des portées touchées n'ont pas présenté de signes cliniques. D'après Straw et al. (1999) et Taylor (1995), l'effet aléatoire de la maladie dans une portée semble être lié à la croissance et à l'ingestion de colostrum, les porcelets bien développés qui ont bu plus de colostrum étant ceux qui ont été plus gravement atteints. Tous les animaux affectés avaient une bonne condition physique, étaient bien développés et ne perdaient pas leur appétit.
Les porcelets affectés semblent normaux à la naissance (Straw et al., 1999). Différents auteurs ont rapporté différents moments pour la première manifestation de la maladie, entre 7 et 21 jours (Muirhead et al., 1997b), entre 10 et 20 jours (Straw et al., 1999) ou entre 14 et 30 jours. avec un pic plus bas à l'âge de 3 jours (Taylor, 1995). Dans ce cas, la maladie est apparue à l'âge de 7 jours, comme indiqué par Muirhead et al. (1997b).
L'animal peut mourir sans signes cliniques (Muirhead et al., 1997b, Taylor, 1995). Si la peau des porcelets morts est soigneusement observée,on perçoit des hémorragies dans toutes les contusions, les morsures ou traumatismes (Muirhead et al., 1997b). Dans ce cas, il n'a pas été possible de corréler les morts subites causées par le purpura thrombocytopénique avec d'autres causes de mortalité, comme ls écrasements. Cependant, les porcelets affectés sont souvent pâles et on observe que la peau est pourpre, avec des tâches, des hémorragies principalement sur le ventre, et des marques d'égratignure claires. Les muqueuses sont généralement pâles et il n'y a pas de fièvre (Straw et al., 1999, Taylor, 1995). Des hémorragies de différentes tailles sont observées sur l'épicarde, le myocarde, la plèvre, les articulations et les muscles squelettiques. Tous les ganglions lymphatiques sont pleins de sang (Muirhead et al., 1997b, Taylor, 1995). Toutes ces caractéristiques concordent avec le tableau clinique observé dans ce cas.
La castration pendant la période de purpura thrombocytopénique peut augmenter considérablement le taux de mortalité (Straw et al., 1999). La castration n'a pas été effectuée sur cet élevage. Cependant, comme indiqué dans la recherche clinique, après la coupe des queues, le saignement était abondant et il y avait un retard dans le temps de coagulation.
L'incidence de ce problème est faible, moins de 1% selon Taylor, 1995.
Le diagnostic est fait par le tableau clinique et le post-mortem caractéristique (Muirhead et al., 1997b Taylor, 1995). Le diagnostic peut être confirmé par la numération des plaquettes (Taylor, 1995). Dans ce cas, toutes ces procédures ont été suivies. Cependant, les numérations plaquettaires n'ont pas pu être effectuées pour les raisons indiquées au cours des examens de laboratoire.
Aucun autre traitement qu'un bon allaitement n'est connu (Muirhead et al., 1997b, Taylor, 1995). L'utilisation de la vitamine K n'a pas été rapporté (Taylor, 1995), mais il serait intéressant de l'utiliser dans de futures épidémies. Dans les premiers stades de la maladie, il convient de promouvoir l'adoption croisée des portées pour éliminer l'exposition à tout anticorps persistant dans le lait de la truie (Muirhead et al., 1997b), comme cela a été fait dans ce cas. L'alimentation artificielle peut également être pratiquée (Taylor, 1995). Cependant, la mortalité est assez élevée.
Le purpura thrombocytopénique a été décrit chez d'autres espèces, telles que les bovins et les ovins, à la suite d'une intoxication par les fougères (Barlow, R., 1983). Chez l'homme, il résulte d'une étiologie infectieuse, auto-immune, maligne ou idiopathique (Wei, A. et al., 2007).
Quand une truie produit une portée affectée, elle doit être éliminée ou inséminée par un verrat différent lors de la prochaine gestation (Muirhead et al., 1997b, Taylor, 1995). Dans ce cas, il a été décidé d'inséminer les truies affectées avec un autre verrat au lieu de les sacrifier. Cette mesure a été couronnée de succès car aucun cas de purpura thrombocytopénique n'a été signalé depuis.







