Les diagnostics du SDRP ont évolué au fil des ans et incluent plusieurs options de test précieuses. Le type d'animaux à échantillonner et le type de procédure d'échantillonnage dépendront du scénario pour lequel nous effectuerons le test: devrions-nous analyser les truies, les porcelets, les animaux à l'engrais ou tous ? Réalisons-nous un échantillonnage dirigé ou un échantillonnage aléatoire de la population ? Et quelle devrait être notre taille d'échantillon ? Nous devons également décider du type d'échantillon : prenons-nous du sérum, des tissus, des liquides oraux ou du sperme ? Et enfin, nous ne pouvons pas oublier toutes les questions liées au stade de la maladie au moment de l'échantillonnage. Quand les signes cliniques sont-ils apparus ? Nous attendons-nous à ce que le test de diagnostic détecte le virus, identifie la lésion ou détecte des anticorps ? Enfin, il est essentiel que nous comprenions les avantages et les limites de chaque test de diagnostic.
Comprendre les options et choisir la bonne stratégie de diagnostic pour chaque scénario pour lequel nous devons échantillonner le SDRP augmentera l'efficacité de tout programme sanitaire dans les élevages.

Scénarios dans lesquels nous prélevons des échantillons de SDRPv
Le scénario le plus évident est d'enquêter sur la maladie, lorsque les symptômes d'une éventuelle épidémie de SDRP apparaissent sur une élevage négatif ou stable. Dans ce cas, les vétérinaires effectuent le test pour comprendre la cause des signes cliniques et l'origine du pathogène à l'origine des problèmes. Un autre scénario très courant est celui où l'absence de SDRP est surveillée dans un élevage auparavant positif et instable qui s'est engagé dans une stratégie de contrôle ou d'éradication et souhaite analyser ses progrès. Enfin, les tests SDRP sont extrêmement courants à des fins de surveillance des maladies. Dans ce dernier scénario, les tests sont effectués sur des élevages négatifs et nécessitent généralement un plus grand nombre d'échantillons pour maximiser la confiance dans le statut indemne de SDRP de la population.
Nos objectifs diagnostiques guideront le choix du test
Historiquement, nous avons classé les tests de diagnostic du SDRP en 3 types :
- Ceux qui détectent la lésion : observations post mortem et histopathologie, qui ne peuvent être réalisées qu'en laboratoire au microscope. Les tests de dépistage des lésions sont le plus souvent utilisés dans les éclosions de SDRP cliniquement évidentes;
- Ceux qui détectent le virus : polymerase chain reaction (PCR), isolement du virus (VI) et tests immunohistochimiques (IHC). La détection virale est l'outil de diagnostic le plus fiable pour la confirmation précoce de la présence du virus;
- Ceux qui détectent les anticorps : test d'immunoabsorption lié à une enzyme (ELISA), test d'immunoperoxydase en monocouche (IPMA) et test d'immunofluorescence indirecte (IFA). La confirmation immunologique du contact avec le SDRPv nécessite une période de détection plus longue, mais confirme l'exposition lorsque le virus ne peut pas être détecté.
Image 1. Plaque ELISA à fond plat avec 96 puits utilisée pour la sérologie SDRPv. Les échantillons positifs sont affichés en bleu. Source: Base Pair Biotechnologies.
Les caractéristiques du test déterminent sa valeur
Il est très important de connaître la SENSIBILITÉ (SE) et la SPÉCIFICITÉ (SP) pour tout test de diagnostic. La connaissance de ces informations permet d'interpréter et d'agir de manière appropriée sur les résultats possibles.
- SE : est la capacité d'un test de diagnostic à identifier correctement les échantillons vraiment positifs. Un test avec une SE faible aura trop de faux négatifs.
- SP: est la capacité d'un test de diagnostic à identifier correctement les échantillons vraiment négatifs. Un test avec un SP faible aura trop de faux positifs
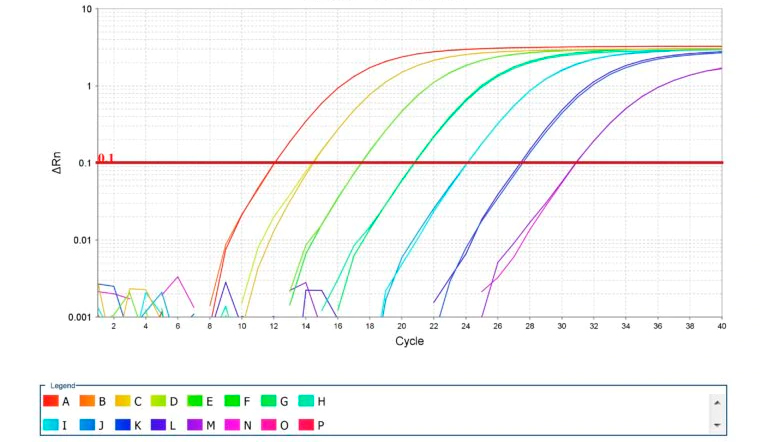
Image 2. Amplification des courbes standard pour la PCR quantitative. Source: Thermo Fisher Scientific Inc.
Options de diagnostic en fonction du scénario SDRP
Tous les scénarios et options de diagnostic sont résumés dans le tableau 1.
1. Enquête sur une épidémie : Dans un élevage connaissant une épidémie, l'objectif du protocole de diagnostic sera de confirmer l'infection et, si possible, de caractériser génétiquement la souche. L'implication précoce du vétérinaire dans l'épidémie aidera à atteindre ces objectifs efficacement. S'il y a des porcs avec des signes cliniques classiques, un échantillonnage sélectif de ces animaux est recommandé pour rechercher des lésions macroscopiques. Après avoir identifié des lésions représentatives (c'est-à-dire des poumons lourds semblables à du marbre et non effondrés) dans l'élevage, une PCR et une histopathologie doivent être effectuées pour confirmer le diagnostic. Ensuite, un séquençage génétique doit être effectué pour identifier la souche. Le séquençage est la clé pour comprendre l'épidémiologie (c'est-à-dire l'origine, résidente ou émergente) du nouveau virus possible par comparaison avec d'autres souches connues.
2. Suivi de la maladie : pour minimiser l'impact négatif de la maladie en raison de l'instabilité de la production dans un élevage à SDRP positif, des programmes de contrôle (parfois suivis d'éradication) doivent être mis en œuvre dès que possible pour produire des porcelets négatifs. Les objectifs du programme de diagnostic dans ce cas seront de démontrer les paramètres clés qui indiquent la stabilité du SDRP (c'est-à-dire l'acclimatation du renouvellement, l'immunité de l'élevage de truies et la production de porcelets négatifs). La sérologie est utilisée pour confirmer une bonne exposition de l'élevage de truies et la PCR est utilisée pour confirmer l'absence du virus chez les porcelets nouveau-nés et sevrés. Dans ces conditions, nous utilisons des tests avec un SE élevé (c'est-à-dire aussi peu de faux négatifs que possible). Parce que nous avons affaire à un élevage où la prévalence attendue de porcelets positifs pour le SDRP est très faible ou absente, un grand nombre d'échantillons sera nécessaire pour confirmer le statut du SDRP avec un haut degré de confiance. En supposant l'absence de porcelets cliniquement affectés, les porcelets sélectionnés au hasard et les cochettes négatives nouvellement introduites dans l'élevage sont les meilleures populations à échantillonner. La plupart des types d'échantillons (c'est-à-dire le sérum, les fluides oraux, les fluides de traitement et les tissus) sont précieux, mais il est important de comprendre les différences de SE et de SP entre les tests lors de l'évaluation des résultats. Lorsque cela est possible, l'agrégation d'échantillons ("pooling") doit toujours être envisagée, afin de rendre l'analyse plus abordable.
3. Surveillance de la maladie : en surveillant la maladie dans les élevages négatifs, nous sélectionnons généralement les tests ayant la SP le plus élevé (c'est-à-dire le moins de résultats faussement positifs) possible. Ces élevages (par exemple, les centres d'insémination ou de multiplicateurs), dans de nombreuses occasions, doivent documenter régulièrement leur état. Dans le cas des élevages de truies, le test ELISA est la meilleure option pour montrer l'absence d'exposition au SDRPv. Il est abordable, rapide et a un bon SE et SP. Il est courant que ces élevages effectuent un test sérologique secondaire pour déterminer si leurs résultats positifs inattendus (généralement 1 à 2% du total des échantillons) sont de vrais ou faux positifs. Le test d'immunofluorescence indirecte (IFA) ou le test d'immunoperoxydase en monocouche (IPMA), tous deux basés sur la coloration indirecte de monocouches préparées sur des cellules infectées, servent de tests de confirmation communs pour les positifs inattendus à l'ELISA. La PCR en tant que test de détection précoce est utilisée dans: 1) les liquides oraux avant la livraison de cochettes de remplacement âgées; et 2) des échantillons de sérum ou de sang de verrats dans les centres d'insémination.
En résumé, choisir les bons tests, au bon moment, chez les bons animaux et les interpréter correctement augmentera la vitesse, la précision et la rentabilité de nos stratégies de diagnostic du SDRP.
Tableau 1. Résumé des scénarios et stratégies de diagnostic.
Enquête sur une épidémie
- Statut du SDRP de l'élevage
- Instable en SDRP
- Transmission active du virus
- Nouvelle introduction de SDRPv
- Prévalence élevée de la maladie
- Objectifs du diagnostic
- Détection d'infection
- Identification de la souche de SDRPv
- Animaux
- Ceux qui ont des symptômes cliniques
- Mort-nés
- Types d'échantillonnage
- Échantillonnage dirigé
- Moins d'animaux
- Échantillons groupés (poolés)
- Echantillon
- Tissu
- Sérum
- Première option de diagnostic
- Autopsie pour identifier la lésion
- Avantages
- Très rapide"
- À l'élevage
- Ce n'est pas cher
- Inconvénients
- SE / SP faibles
- Deuxième option de diagnostic
- PCR / séquençage de virus pour détecter / identifier la souche PRRSV
- Avantages
- SE / SP élevées
- Rapide, 24h
- Les résultats peuvent être quantifiés (RT-qPCR)
- Inconvénients
- Cas potentiels de faux positifs dus à une contamination croisée: assurer une manipulation correcte de l'échantillon (pendant l'échantillonnage et le traitement).
Suivi de la maladie
- Statut SDRP de la'élevage
- Stable
- Souche PRRS autochtone de l'élevage
- Faible prévalence de la maladie
- Objectifs du diagnostic
- Surveillance de la stabilité / contrôle
- Suivi des programmes d'éradication
- Animaux
- Porcelets (nouveau-nés et sevrés)
- Remplacement
- Types d'échantillonnage
- Échantillonnage aléatoire / nombre élevé d'animaux
- Échantillon ciblé / petit nombre d'animaux
- Échantillons groupés (pools)
- Echantillons
- Fluides oraux
- Sérum
- Liquides de traitement
- Liquides de langue de porcelet
- Première option de diagnostic
- PCR pour détecter l'antigène (ARN) ≈7 jours après l'infection
- Avantages
- SE / SP élevées
- Rapide, 24h
- Les résultats peuvent être quantifiés (RT-qPCR)
- Inconvénients
- Cas potentiellement faussement positifs en raison de la contamination croisée: assurer une manipulation correcte des échantillons (pendant l'échantillonnage et le traitement)
- Deuxième option de diagnostic / option alternative
- ELISA pour détecter les anticorps (IgM, IgG, N) à partir de ≈14 jours après l'infection
- Avantages
- Faible coût par échantillon
- Résultats en 2 à 4 jours
- Confirmation en laboratoire de l'absence d'exposition au virus
- Inconvénients
- Faible SP
- Impossible de faire la différence entre l'exposition au virus du vaccin et au virus de terrain
- Les résultats ne peuvent pas être quantifiés
Surveillance sanitaire
- Statut SDRP de l'élevage
- Elevage négatif en SDRPv
- Objectifs diagnostics
- Assurer le statut négatif
- Animaux
 |
|
4. Types d'échantillonnage
|
4. Types d'échantillonnage
|
|
5. Echantillon
|
5. Echantillon
|
|
6a. Première option de diagnostic (truies, nullipares et porcelets)
6b. Deuxième option de diagnostic (renouvellement)
7. Seconde option de diagnostic
|
6. Première option de diagnostic
|











