Tests disponibles
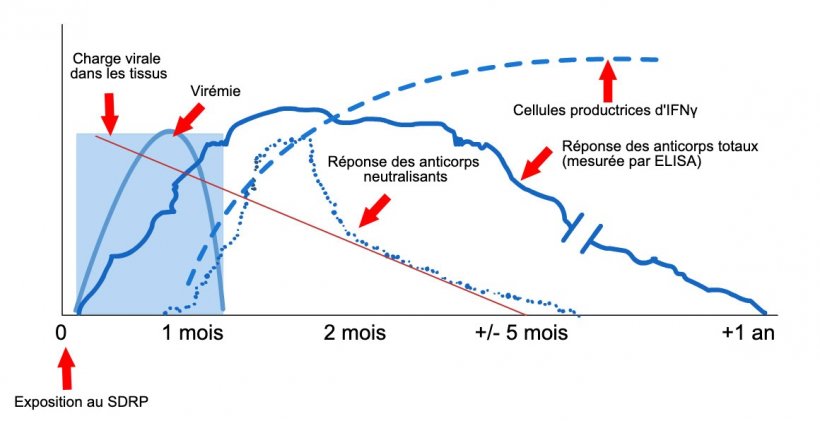
Schéma de détection du virus et des anticorps après exposition au SDRP : le graphique montre les changements de concentration (axe Y) au fil du temps (axe X) des différents analytes utilisés dans les tests. Après exposition au virus du SDRP, le virus apparaît dans le sang (virémie) qui dure généralement entre 2 et 4 semaines, selon l'âge et le statut immunitaire du porc. La séroconversion (détection des anticorps) survient généralement 7 à 10 jours après l'exposition et dure plusieurs mois avant de devenir séronégative. Les anticorps neutralisants apparaissent entre 4 et 6 semaines après l'exposition (López et Osorio, 2004).

Polymerase Chain Reaction (PCR)
- Détecte la présence de séquences spécifiques d'acide nucléique viral (ARN).
- Types d'échantillons : tissus, sang, sérum, fluides oraux, etc.
- Avantages:
- Des amorces indépendantes sont utilisées pour détecter simultanément le SDRP de type 1 (européen) et de type 2 (nord-américain) dans le même échantillon.
- Très haute sensibilité (peut détecter de petites quantités de virus).
- Détection précoce : les cas aigus devraient être positifs.
- De nombreux types d'échantillons peuvent être utilisés (tissus, sang, sérum, fluides oraux, etc.).
- Coût modéré :
- Souvent, 5 échantillons de sérum ou de tissu peuvent être regroupés pour réduire les coûts et minimiser la perte de sensibilité.
- Les échantillons de salive ne sont généralement pas regroupés car la valeur Ct (nombre de cycles nécessaires pour amplifier l'ARN viral à un niveau détectable) sera plus élevée (car les concentrations virales sont plus faibles), ce qui peut entraîner une perte significative de sensibilité.
- Inconvénients:
- Le laboratoire doit mettre à jour périodiquement les amorces pour éviter les faux négatifs.
- Les amorces pour le SDRP de type 1 et de type 2 doivent être mises à jour.
- Le séquençage est nécessaire pour différencier le virus vaccinal de l'infection par le virus sauvage.
- Le laboratoire doit mettre à jour périodiquement les amorces pour éviter les faux négatifs.
Test ELISA
- Recherche la présence d'anticorps.
- Types d'échantillons : sérum ou fluides oraux (certains kits).
- Avantages :
- La plupart détectent les anticorps contre les deux types de SDRP.
- Les animaux restent positifs pendant plusieurs mois (3-12 mois).
- Il peut être utilisé dans les cas chroniques.
- Inconvénients:
- Les anticorps spécifiques et le moment de la détection peuvent varier légèrement entre les différents kits commerciaux disponibles.
- Il faut 7 à 10 jours pour que les animaux deviennent séropositifs.
- Il ne fait pas la différence entre les anticorps maternels et les anticorps dûs à une infection sauvage.
- Il ne fait pas de distinction entre la vaccination et l'infection virale sauvage
Immunohistochimie (IHC)
- Détecte la présence des antigènes viraux.
- Types d'échantillons : tissus.
- Avantages :
- Détecte le virus sur le site de la lésion (bonne preuve de causalité).
- Permet de différencier les quantités faibles, modérées et élevées de virus présents.
- Inconvénients:
- Le bon échantillon de tissu doit être envoyé.
- Elle nécessite une quantité de virus nettement plus élevée que la PCR.
- Elle n'évalue qu'une petite quantité de tissu.
Séquençage génétique
- Séquence les acides nucléiques génétiques du virus (ARN).
- Type d'échantillons : tissus, sang, sérum, fluides oraux, etc.
- Avantages :
- Il permet de différencier les virus de terrain et les vaccins.
- Il peut aider à différencier l'introduction de nouveaux virus des virus existants ou ceux du passé.
- Inconvénients :
- Cher.
- Souvent, seul ORF5 est séquencé, ce qui représente 600 paires de bases sur environ 15 000.
- Les échantillons avec des valeurs CT élevées (> 34) ont tendance à être plus difficiles à séquencer.
Tableau 1: Succès du séquençage du laboratoire de diagnostic vétérinaire de l'Iowa State University basé sur les valeurs de seuil du cycle de PCR pour le SDRP (Ct) dans des échantillons de salive. Chris Rademacher et coll. 2016.
| Echantillon | intervalle des Ct de la PCR | Total des échantillons analysés | Nombre d'échantillons séquencés | % échantillons positifs séquencés |
|---|---|---|---|---|
| Tous les échantillons | <30 | 2016 | 2013 | 99,85 |
| 30,00-31,99 | 389 | 361 | 92,80 | |
| 32,00-33,99 | 324 | 265 | 81,79 | |
| 34,00-35,99 | 185 | 109 | 58,92 | |
| 36,00-37,00 | 65 | 26 | 40,00 |
Immunofluorescence indirecte
- Détecte la présence d'anticorps.
- Types d'échantillons : sérum.
- Avantages :
- Avec la PCR, elle peut être utilisée pour confirmer un échantillon ELISA inopinément positif.
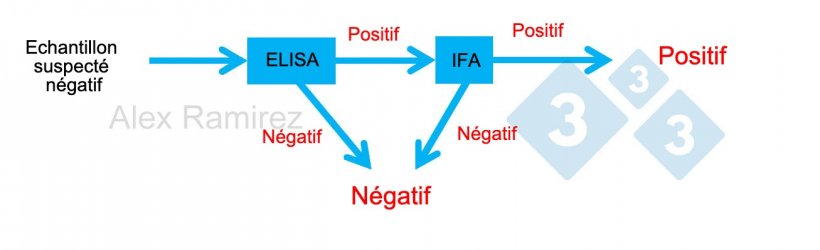
Schéma montrant l'utilisation de l'IFA SDRP comme test de confirmation pour les échantillons qui sont inopinément positifs en SDRP par ELISA. Un échantillon soupçonné d'être négatif et négatif en ELISA est considéré comme négatif. Si cet échantillon est inopinément positif, une IFA SDRP peut être effectuée comme test de confirmation. Si le test IFA est positif, l'échantillon est confirmé comme positif. Si le test IFA est négatif, nous supposerons qu'il s'agissait d'un faux positif tant que la PCR est également négative pour confirmer qu'il n'y a pas d'infection récente.
- Avec la PCR, elle peut être utilisée pour confirmer un échantillon ELISA inopinément positif.
- Inconvénients:
- Ce n'est pas faisable pour un grand nombre d'échantillons.
- Les résultats dépendent de l'isolat viral utilisé dans le test.
- La fiabilité dépend fortement de la compétence des techniciens.
Interprétation des résultats
PCR
- Positif - Le virus est présent / en circulation, ce qui suggère fortement une causalité, en particulier à des valeurs de Ct basses et à la présence de signes cliniques. Une vaccination récente avec un virus vivant modifié peut entraîner une PCR positive.
- Négatif - Négatif ou le virus n'est pas détecté si le test est effectué longtemps après l'infection.
ELISA
- Positif - anticorps maternels ou exposition antérieure (généralement> 7 à 10 jours) au vaccin ou au virus de terrain.
- Négatif - Négatif ou infection trop récente pour être détectée (normalement, le test devrait avoir lieu au moins 7 à 10 jours après l'exposition).
IHC
- Positif - Le virus est présent sur le site de la lésion.
- Négatif - Négatif ou infection trop ancienne pour détecter les virus.
Séquençage génétique
- Virus vaccinal - > 99% d'homologie attendue
- Virus sauvage - Une perte d'homologie de 1 à 2% par an est estimée.
IFA
- Positif - Anticorps maternels ou exposition antérieure (> 7 à 10 jours) au vaccin ou au virus sauvage.
- Négatif - Négatif ou infection trop récente pour être détectée (doit être fait au moins 7 à 10 post-exposition).
Scénarios

Avortements de truies / clochettes
- Fœtus avortés : Prélevez 6-8 fœtus pour regrouper les échantillons pour la PCR. Seulement environ 50% des fœtus seront positifs en PCR (donc de nombreux fœtus doivent être échantillonnés), mais les fœtus positifs auront une concentration virale élevée de sorte que 10 échantillons peuvent être regroupés pour la PCR.
- Truies / cochettes avortées : Prélevez le sérum de truies / cochettes récemment avortées (<10 jours) pour la PCR. Ils peuvent être mélangés en groupes de 5. Les tests ELISA ne sont pas utiles car les truies / cochettes non exposées mettront 7 à 9 jours pour être positives.
Problèmes de reproduction chez les truies / cochettes
- Prélevez 15 à 20 échantillons de femelles affectées et 15 à 20 de femelles non affectées (30 à 40 échantillons au total) et analysez-les par PCR (groupes de 5 ou 6) et ELISA (individuellement).
Porcelets nés faibles
- Vous pouvez collecter des fluides oraux familiers de diverses portées avec des porcelets faibles et les analyser par PCR.
- Vous pouvez collecter des testicules (si vous castrez), des queues, des langues (d'animaux morts) sur des porcelets de différentes portées dans la maternité. De nombreux échantillons peuvent être regroupés pour analyse.
- Prélevez des échantillons de sérum de 10 portées affectées (2 ou 3 porcelets par portée) et analysez-les par PCR en pools de 5 ou 6. Assurez-vous que les porcelets n'ont pas été vaccinés contre le SDRP.
Porcs d'engraissement présentant des signes cliniques aigus de SDRP
- Prélevez les fluides oraux de 4 à 6 cases différentes et analysez-les individuellement par PCR. Ne regroupez pas les échantillons.
- Prélever des échantillons de sérum de 15 à 30 porcs présentant des signes cliniques ou prélever au hasard et analyser par PCR. Vous pouvez faire des regroupements de 5 ou 6.
Porcs d'engraissement présentant des signes cliniques chroniques de SDRP
- Prélevez les fluides oraux de 4 à 6 cases différentes et analysez-les individuellement par PCR. Ne regroupez pas les échantillons.
- Prélevez 30 échantillons de sérum de porcs présentant des signes cliniques ou échantillonnez au hasard et analysez-les par PCR. Vous pouvez les mélanger en groupes de 5 ou 6. Vous pouvez également tester des échantillons individuels par ELISA pour confirmer l'exposition.







